Da se podsjetimo - jedinjenja su čiste supstance koje se sastoje od dva ili više hemijskih elemenata i koje se hemijskim putem mogu razložiti na jednostavnije supstance (jednostavnija jedinjenja ili elemente) ; obrnuto - jedinjenja nastaju sjedinjavanjem dva ili više elemenata, kao i u reakcijama između jednostavnijih jedinjenja ili jedinjenja i elemenata.
Važno je uočiti i znati da se fizička i hemijska svojstva elemenata i jedinjenja izgrađenog od tih elemenata međusobno razlikuju. Na primjer - voda, jedinjenje izgrađeno od dva elementa, vodonika i kiseonika, na sobnoj temperaturi je u tečnom agregatnom stanju, dok su vodonik i kiseonik gasovi.
Kuhinjska so (natrijum-hlorid) bijela je, kristalna supstanca (u čvrstom agregatnom stanju). Elementi koji grade kuhinjsku so, natrijum i hlor, imaju svojstva različita od svojstava soli. Natrijum je u čvrstom agregatnom stanju, kao i drugi metali ima metalni sjaj, dok je hlor žutozeleni gas.
Uglavnom, sva se hemijska jedinjenja dijele na organska i neorganska.
NEORGANSKA
ORGANSKA
jedinjenja ugljenika
>50 miliona jedinjenja
karakteristična je kovalentna veza
sastavni su dio živog svijeta
niska temperatura topljenja, Tt
većina je nerastvorna u vodi
većina ne provodi struju - u rastvoru ili rastopu
većina je lako zapaljiva
 Dio nauke koji izučava jedinjenja ugljenika naziva se organska hemija.
Dio nauke koji izučava jedinjenja ugljenika naziva se organska hemija.
Međutim, nijesu sva jedinjenja ugljenika organska. Ugljenik(II)-oksid, ugljenik(IV)-oksid, karbonatna kiselina i njenje soli - karbonati se po svojim svojstvima svrstavaju u neorganska.
- Još u dalekoj prošlosti ljudi su dobijali organske supstance iz biljaka i životinja. Proizvodili su, još prije mnogo godina, opojna pića iz meda, sirće od vina, izdvajali su ljekovite supstance iz biljaka, štavili kožu ubijenih životinja...
Dugo hemičari vještačkim putem nijesu mogli dobiti te supstance koje su izdvajali iz biljaka i životinja. Smatrali su da je hemijskim putem nemoguće pretvoriti neorgansku supstancu u organsku. Pretpostavili su da se ova pretvaranja mogu ostvariti samo u živim organizmima pomoću tajanstvene ''životne sile'', no, ipak, u XIX vijeku naučnici su eksperimentalnim putem opovrgli ovu teoriju.
Veliki udarac je prije svega nanio njemački hemičar Fridrih Veler kada je 1824. godine dobio oksalnu kiselinu (nalazi se u biljkama - spanaću, kupusu, paradajzu, grožđu), a 1828. godine ureu (sastojak mokraće čovjeka i životinja).
1845. Kolbe je dobio etansku kiselinu od koje se pravi sirće, Bertlo je dobio mast. I baš tada, kada je opovrgnuta teorija da se organska jedinjenja mogu stvarati samo u živim organizmima, organska hemija se izdvojila u samostalnu granu nauke.
U čemu leži značaj organske hemije?
Otkrića u oblasti organske hemije omogućila su proizvodnju stotina i hiljada tona važnih hemijskih supstanci bez kojih se ne bi mogao zamisliti život savremenog čovjeka (proizvodnja boja, ljekova, polimernih materijala, kao što su plastične mase, sintetički kaučuk, vještačka vlakna).
Kao što je gore pomenuto, organska hemija broji preko 50 miliona jedinjenja. A da li ste se zapitali koja su to svojstva atoma ugljenika koja omogućavaju građenje tako velikog broja?
Ugljenik je element četrnaeste grupe PSE.

Ima četiri valentna elektrona koji učestvuju u stvaranju kovalentnih veza, te je atom ugljenika četvorovalentan u svim organskim jedinjenjima.
Drugo svojstvo ugljenika je da se njegovi atomi mogu međusobno vezivati u otvorene i zatvorene nizove (prstenove). Tako, na primjer, četiri atoma ugljenika mogu se međusobno povezati jednostrukim kovalentnim vezama na sljedeće načine:



Pored toga, mnogobrojnost organskih jedinjenja posljedica je i činjenice da se dva atoma ugljenika mogu međusobno povezati ne samo jednostrukom već i dvostrukom i trostrukom kovalentnom vezom:


Klasifikacija organskih jedinjenja:
Sva organska jedinjenja se, u zavisnosti od strukture ugljenikovog niza dijele na:
I Aciklična jedinjenja - jedinjenja u čijim su molekulima atomi ugljenika tako međusobno povezani da grade otvorene nizove, koji mogu biti nerazgranati i razgranati.
2. Heterociklična jedinjenja - jedinjenja kod kojih se u prstenu pored ugljenikovih atoma nalaze i drugi atomi - heteroatomi (npr. tiofen).
_
Najjednostavniji predstavnici acikličnih, alicikličnih i aromatičnih jedinjenja su ugljovodonici.
Važno je uočiti i znati da se fizička i hemijska svojstva elemenata i jedinjenja izgrađenog od tih elemenata međusobno razlikuju. Na primjer - voda, jedinjenje izgrađeno od dva elementa, vodonika i kiseonika, na sobnoj temperaturi je u tečnom agregatnom stanju, dok su vodonik i kiseonik gasovi.
Kuhinjska so (natrijum-hlorid) bijela je, kristalna supstanca (u čvrstom agregatnom stanju). Elementi koji grade kuhinjsku so, natrijum i hlor, imaju svojstva različita od svojstava soli. Natrijum je u čvrstom agregatnom stanju, kao i drugi metali ima metalni sjaj, dok je hlor žutozeleni gas.
Uglavnom, sva se hemijska jedinjenja dijele na organska i neorganska.
NEORGANSKA
jedinjenja svih elemenata
>60000 jedinjenja
zastupljene su sve vrste veza
mogu se dobiti u laboratoriji
oksidi, kiseline, baze i soli
većina ima visoku temperaturu topljenja, Tt
većina je dobro rastvorna u vodi
većina provodi struju - u rastvoru ili rastopu
većina ne gori
ORGANSKA
jedinjenja ugljenika
>50 miliona jedinjenja
karakteristična je kovalentna veza
sastavni su dio živog svijeta
niska temperatura topljenja, Tt
većina je nerastvorna u vodi
većina ne provodi struju - u rastvoru ili rastopu
većina je lako zapaljiva
 Dio nauke koji izučava jedinjenja ugljenika naziva se organska hemija.
Dio nauke koji izučava jedinjenja ugljenika naziva se organska hemija.Međutim, nijesu sva jedinjenja ugljenika organska. Ugljenik(II)-oksid, ugljenik(IV)-oksid, karbonatna kiselina i njenje soli - karbonati se po svojim svojstvima svrstavaju u neorganska.
- Još u dalekoj prošlosti ljudi su dobijali organske supstance iz biljaka i životinja. Proizvodili su, još prije mnogo godina, opojna pića iz meda, sirće od vina, izdvajali su ljekovite supstance iz biljaka, štavili kožu ubijenih životinja...
Dugo hemičari vještačkim putem nijesu mogli dobiti te supstance koje su izdvajali iz biljaka i životinja. Smatrali su da je hemijskim putem nemoguće pretvoriti neorgansku supstancu u organsku. Pretpostavili su da se ova pretvaranja mogu ostvariti samo u živim organizmima pomoću tajanstvene ''životne sile'', no, ipak, u XIX vijeku naučnici su eksperimentalnim putem opovrgli ovu teoriju.
Veliki udarac je prije svega nanio njemački hemičar Fridrih Veler kada je 1824. godine dobio oksalnu kiselinu (nalazi se u biljkama - spanaću, kupusu, paradajzu, grožđu), a 1828. godine ureu (sastojak mokraće čovjeka i životinja).
1845. Kolbe je dobio etansku kiselinu od koje se pravi sirće, Bertlo je dobio mast. I baš tada, kada je opovrgnuta teorija da se organska jedinjenja mogu stvarati samo u živim organizmima, organska hemija se izdvojila u samostalnu granu nauke.
U čemu leži značaj organske hemije?
Otkrića u oblasti organske hemije omogućila su proizvodnju stotina i hiljada tona važnih hemijskih supstanci bez kojih se ne bi mogao zamisliti život savremenog čovjeka (proizvodnja boja, ljekova, polimernih materijala, kao što su plastične mase, sintetički kaučuk, vještačka vlakna).
Kao što je gore pomenuto, organska hemija broji preko 50 miliona jedinjenja. A da li ste se zapitali koja su to svojstva atoma ugljenika koja omogućavaju građenje tako velikog broja?
Ugljenik je element četrnaeste grupe PSE.

Drugo svojstvo ugljenika je da se njegovi atomi mogu međusobno vezivati u otvorene i zatvorene nizove (prstenove). Tako, na primjer, četiri atoma ugljenika mogu se međusobno povezati jednostrukim kovalentnim vezama na sljedeće načine:



Pored toga, mnogobrojnost organskih jedinjenja posljedica je i činjenice da se dva atoma ugljenika mogu međusobno povezati ne samo jednostrukom već i dvostrukom i trostrukom kovalentnom vezom:


Klasifikacija organskih jedinjenja:
Sva organska jedinjenja se, u zavisnosti od strukture ugljenikovog niza dijele na:
I Aciklična jedinjenja - jedinjenja u čijim su molekulima atomi ugljenika tako međusobno povezani da grade otvorene nizove, koji mogu biti nerazgranati i razgranati.
II Ciklična jedinjenja - jedinjenja u čijim su molekulima atomi ugljenika tako međusobno povezani da obrazuju prstenove. Zavisno od toga da li je prsten obrazovan samo od atoma ugljenika ili se u prstenu nalazi i atom nekog drugog elementa, ciklična jedinjenja dijele se na:
1. Karbociklična jedinjenja - jedinjenja kod kojih se u prstenu nalaze samo ugljenikovi atomi.
Karbociklična jedinjenja mogu biti aliciklična (npr. ciklopentan) i aromatična (npr. benzen).
1. Karbociklična jedinjenja - jedinjenja kod kojih se u prstenu nalaze samo ugljenikovi atomi.
Karbociklična jedinjenja mogu biti aliciklična (npr. ciklopentan) i aromatična (npr. benzen).
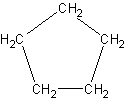 |
| Ciklopentan |
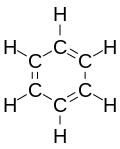 |
| Benzen |
 |
| Tiofen |
Najjednostavniji predstavnici acikličnih, alicikličnih i aromatičnih jedinjenja su ugljovodonici.

